試劑
我們的試劑品牌很多,都是高品質的試劑

血液/細胞/組織基因組DNA提取試劑盒
基本售價:273.00元
血液/細胞/組織基因組 DNA 純化試劑盒 產品組成 GF304-02 GF304-03 (50 preps) (200 preps) 溶液 GA (Buffer GA) 15 ml 60 ml 溶液 BG (Buffer BG) 30ml 120ml 蛋白酶 K (20mg/ml) 1.1ml 4*1.1ml 漂洗液 PW (Buffer PW) 16ml(使用前請先加入 64ml 無水乙醇) 64ml(使用前請先加入 256ml 無水乙醇) 洗脫緩沖液 TB (Buffer TB) 15 ml 60 ml 吸附柱 CG1 (Spin Columns CG1) 50 個 200 個 收集管(2 ml) (Collection Tubes 2ml) 50 個 200 個 選配試劑紅細胞裂解液(Red Cell Lysis Buffer 貨號:GF1201-01);RNase A (100mg/ml) 貨號:GF0201-01) 儲存條件該試劑盒置于室溫(15-25℃)干燥條件下,可保存18個月,更長時間的保存可置于2-8℃。2-8℃保 存條件下,若溶液產生沉淀,使用前應將試劑盒內的溶液在室溫放置一段時間,必要時可在37℃水浴中預 熱10 min,以溶解沉淀。 產品簡介及特點本試劑盒采用可以特異性結合DNA 的離心吸附柱,和獨特的緩沖液系統,能高效、專一吸附DNA,可有 效去除雜質蛋白及細胞中其他有機化合物,用來提取多種細胞中的基因組 DNA。不需要苯酚、氯仿等有機溶劑,安全方便;提取的基因組 DNA 片段大,純度高,質量穩定可靠。根據不同的樣本量和樣本類型,可以提取的DNA 產量范圍為 1-40ug。 使用本試劑盒回收的 DNA 可適用于各種常規操作,包括酶切、PCR、文庫構建、Southern 雜交等實驗。 注意事項 1. 樣品應避免反復凍融,否則會導致提取的DNA 片段較小且提取量也下降。2. 若溶液 GA 或溶液BG 中有沉淀,可在 37℃水浴中重新溶解,搖勻后使用。 3. 所有離心步驟均為使用臺式離心機,室溫下離心。操作步驟 使用前請先在漂洗液PW中加入無水乙醇,加入體積請參照瓶上的標簽。1.處理材料a. 如提取材料為血液,可直接使用 200μl 新鮮、冷凍或加入各種抗凝劑的血液,不足 200 μl 可加溶液GA 補足;注意:如需處理更大體積血液,如 300μl-1 ml,應按以下步驟操作:在樣品中加入 3 倍體積紅細胞裂解液 (例如,300μl 血液加入 900μl 紅細胞裂解液),顛倒混勻,室溫放置 5 min,期間再顛倒混勻幾次。10000 rpm(~11,500×g)離心 1 min(若離心機最高轉速不允許,可 3000 rpm(~3,400×g)離心5 min),吸去上清,留下白細胞沉淀,加 200 μl 溶液 GA,振蕩至徹底混勻。 紅細胞裂解液本公司另外有售(貨號:GF1201-01),可根據需要來決定購買。 b. 如果處理血樣為禽類、鳥類、兩棲類或更低級生物的抗凝血液,其紅細胞為有核細胞,因此處理量 5- 20μl,可加溶液 GA 補足 200 μl 后進行下面的裂解步驟。c. 貼壁培養的細胞應先處理為細胞懸液,然后 10,000 rpm(~11,200×g)離心 1 min,倒盡上清,加 200 μl 溶液GA,振蕩至徹底懸浮。d. 動物組織(脾組織用量應少 10 mg)應先打碎處理為細胞懸液,然后 10,000rpm(~11,200×g)離心 1 min,倒盡上清,加 200 μl 緩沖液 GA,振蕩至徹底懸浮。注意:如果需要去除RNA,可加入 4 μl RNaseA(100 mg/ml)溶液(客戶自備,目錄號:GF0201-01), 振蕩 15 sec,室溫放置 5 min。2. 加入 20μl Proteinase K 溶液,混勻。 a.提取血液基因組時,加入Proteinase K,混勻,即可繼續進行下一步。 b.提取細胞基因組時,加入Proteinase K,混勻,即可繼續進行下一步。 c.提取組織基因組時,加入 Proteinase K 混勻后,在 56℃放置,直至組織溶解,簡短離心以去除管蓋內壁的水珠,再進行下一步驟。注意:不同組織裂解時間不同,通常需 1-3 h 即可完成(鼠尾需要消化過夜),每小時顛倒混合樣品 2-3次,用水浴振蕩器也可。3. 加入 200ul 溶液 BG,充分顛倒混勻,70℃放置 10 min,溶液應變清亮,簡短離心以去除管蓋內壁的水珠。注意:加入溶液 BG 時可能會產生白色沉淀,一般 70℃放置時會消失,不會影響后續實驗。如溶液未變清亮,說明細胞裂解不徹底,可能導致提取 DNA 量少和提取出的DNA 不純。當血液體積≤200μl 且沒有采用紅細胞裂解處理,或是樣本儲存條件不佳,水浴后顏色可能為深褐色,注意溶液中沒有團塊等沉淀。4. 加入 200ul 無水乙醇,充分振蕩混勻 15sec,此時可能會出現絮狀沉淀,簡短離心以去除管蓋內壁的水珠。 5. 將上一步所得溶液和絮狀沉淀都加入一個吸附柱CG1 中(吸附柱放入收集管中),12,000 rpm (~13,400×g)離心 30 sec,倒掉廢液,將吸附柱CG1 放回收集管中。 6. 向吸附柱CG1 中加入 300μl 溶液BG,12,000rpm (~13,400×g)離心 30 sec,倒掉廢液,將吸附柱 CG1 放入收集管中。注意:這一步驟對于清除內切酶是必不可少的,以防止污染。7. 向吸附柱CG1 中加入700μl 漂洗液PW(使用前請先檢查是否已加入無水乙醇),12,000 rpm (~13,400×g)離心 30 sec,倒掉廢液,將吸附柱CG1 放入收集管中。 8. 重復操作步驟 7。9. 將吸附柱CG1 放回收集管中,12,000 rpm(~13,400×g)離心 2 min,倒掉廢液。將吸附柱 CG1 置于室溫放置數分鐘,以徹底晾干吸附材料中殘余的漂洗液。注意:這一步的目的是將吸附柱中殘余的漂洗液去除,漂洗液中乙醇的殘留會影響后續的酶反應(酶切、 PCR 等)實驗。10. 將吸附柱 CG1 轉入一個干凈的離心管中,向吸附膜的中間部位懸空滴加 50-200μl 洗脫緩沖液TB,室溫放置 2-5 min,12,000 rpm (~13,400×g)離心 2 min,將溶液收集到離心管中。注意:洗脫液體積不應少于 50μl,體積過小影響回收效率。洗脫液的 pH 值對于洗脫效率有很大影響。若用ddH2O 做洗脫液應保證其 pH 值在 7.0-8.5 范圍內,pH 值低于 7.0 會降低洗脫效率;DNA 產物應保存在-20℃,以防 DNA 降解。為增加基因組 DNA 的得率,可將離心得到的溶液再加入吸附柱 CG1 中,室溫放置 2 min,12,000 rpm(~13,400×g )離心 2 min。

通用型DNA純化回收試劑盒
基本售價:944.00元
儲存條件該試劑盒置于室溫(15-25℃)干燥條件下,可保存18個月,更長時間的保存可置于2-8℃。2-8℃保存條件下,若溶液產生沉淀,使用前應將試劑盒內的溶液在室溫放置一段時間,必要時可在37℃水浴中預熱10 min,以溶解沉淀。產品簡介及特性本試劑盒采用獨特的緩沖液體系和離心吸附柱,既能從TAE或TBE瓊脂糖凝膠中回收100 bp-20 kb大小的DNA片段,又能用于直接純化PCR產物,滿足多種實驗需要。整個純化過程可在15分鐘完成、不需進行苯酚萃取及酒精沉淀、純化的DNA無鹽類或大分子的污染。如果回收前DNA量為1-5ug,建議選用超薄DNA產物純化試劑盒GF203或超薄瓊脂糖凝膠回收試劑盒DF208,推薦洗脫液體積20-50ul。a.使用相同的溶液,可進行三種不同的應用(PCR 產物純化、DNA 產物純化、膠體回收)。b.每一離心管柱可處理達 150ul 的 DNA 溶液或 PCR 反應產物,DNA 回收率可達 80%~95%。c.可用于以 TAE 或 TBE 緩沖液配制的瓊脂糖凝膠的 DNA 回收,DNA 回收率可達 60~90%。注意事項1.電泳時應使用新的電泳緩沖液,以免影響電泳和回收效果。2.如下一步實驗要求較高,則應盡量使用 TAE 電泳緩沖液。3.切膠時,紫外照射時間應盡量短,以免對 DNA 造成損傷。4.洗脫緩沖液加量應根據回收前DNA量來決定:如回收前DNA只有1-5μg左右(推薦選用GF203或GF208超薄型試劑盒),加20-50μl洗脫液;如回收前有5-15μg左右DNA,加30-100μl洗脫緩沖液;如回收前有15-30μg左右DNA,加50-300μl洗脫緩沖液。5.回收率與初始 DNA 量和洗脫體積有關,初始量越少、洗脫體積越少,回收率越低。6.對于<100 bp 和>10 kb 的 DNA 片段可以適當的增加吸附和洗脫的時間。操作步驟使用前請先在漂洗液PW中加入無水乙醇,加入體積請參照瓶上的標簽。所有離心步驟均為使用臺式離心機在室溫下離心。一、從 PCR 反應液或酶切反應液中回收 DNA 1.完成 PCR 擴增或其他酶切反應操作后,移取反應混合液(含有預純化的 DNA)至干凈的離心管。 2.加入 3 倍體積的溶液 PC 至反應混合液中(如 50ul 反應混合液加入 150ul 的結合液),震蕩混合均勻。 3.將吸附柱放入收集管中,移取上一步混合液至吸附柱,室溫放置 2 min,以 12,000 rpm(~13,400×g )離心 1 分鐘,丟棄收集管中的懸液,將吸附柱 CB1 放回收集管中。 注意:若樣本體積超過 700ul,可分次加入并重復此步驟。 4.加入 700ul 的漂洗液至吸附柱中,靜置 1 分鐘以平衡管柱膜,于 12,000 rpm(~13,400×g )離心 1 分鐘,丟棄懸液,將吸附柱 CB1 放回收集管中。 5.重復操作步驟 4。 6.將吸附柱 CB1 放回收集管中,12,000 rpm(~13,400×g )離心 2 分鐘,將吸附柱開蓋置于室溫放置數分鐘,以去除、晾干殘余的漂洗液。 注意:漂洗液中乙醇的殘留會影響后續的酶切、PCR 等實驗 7.將吸附柱 CB1 置于一個干凈離心管中,向吸附膜中間位置懸空滴加適量的洗脫緩沖液 TB,室溫放置 2 min。12,000 rpm (~13,400×g )離心 2 min 收集 DNA 溶液。 注意:洗脫體積不應小于 30 μl,體積過少影響回收效率。洗脫液的 pH 值對于洗脫效率有較大影響,若后續做測序,需使用 ddH2O 做洗脫液,并保證其 pH 值在 7.0-8.5 范圍內,pH 值低于 7.0 會降低洗脫效率;且 DNA 產物應保存在-20°C,以防 DNA 降解。為了提高 DNA 的回收量,可將離心得到的溶液重新加回離心吸附柱中,室溫放置 2 min,12,000 rpm(~13,400×g)離心 2 min,將 DNA 溶液收集到離心管。 二、從瓊脂糖凝膠中回收 DNA 片段 1.完成電泳后,將單一的目的 DNA 條帶從瓊脂糖凝膠中切下(盡量切除多余部分)放入干凈的離心管中,稱取重量(如果凝膠重為 0.1 g,其體積可視為 100 μl)。 2.向膠塊中加入 2 倍體積(如果瓊脂糖凝膠濃度>2%,則加入 3 倍體積)的溶液 PC,60℃水浴孵育 5-15 min或更久,其間不斷溫和地上下翻轉離心管,直至膠塊充分溶解(若膠塊的體積過大,可事先將膠塊切成碎塊)。 注意:膠塊完全溶解后將膠溶液溫度降至室溫再上柱,因為吸附柱在室溫時結合 DNA 的能力較強。 3.將吸附柱放入收集管中,移取上一步溶膠液至吸附柱,以 12,000 rpm(~13,400×g )離心 1 分鐘,丟棄收集管中的濾液,將吸附柱 CB1 放回收集管中。 注意:若樣本體積超過 700ul,可分次加入并重復此步驟。 4.可選步驟:向吸附柱 CB1 加入 400ul 的溶液 PC,以 12,000 rpm(~13,400×g )離心 1 分鐘,丟棄收集管中的濾液,將吸附柱 CB1 放回收集管中(此步驟可去除殘余的瓊脂糖凝膠,以避免純化的 DNA 進行酶切反應時出現抑制現象)。 5.向吸附柱加入 700ul 的漂洗液,靜置 1 分鐘以平衡管柱膜,于 12,000 rpm(~13,400×g )離心 1 分鐘,丟棄濾液,將吸附柱 CB1 放回收集管中。 6.重復操作步驟 5。 7.將吸附柱 CB1 放回收集管中,12,000 rpm(~13,400×g )離心 2 分鐘,將吸附柱開蓋置于室溫放置數分鐘,以去除、晾干殘余的漂洗液。 注意:漂洗液中乙醇的殘留會影響后續的酶切、PCR 等實驗。 8.將吸附柱 CB1 置于一個干凈離心管中,向吸附膜中間位置懸空滴加適量洗脫液 TB,靜置 2 分鐘,室溫放置 2 min,12,000 rpm (~13,400×g )離心 2 min 收集 DNA 溶液。 注意:洗脫體積不應小于 30 μl,體積過少影響回收效率。洗脫液的 pH 值對于洗脫效率有較大影響,若后續做測序,需使用 ddH2O 做洗脫液,并保證其 pH 值在 7.0-8.5 范圍內,pH 值低于 7.0 會降低洗脫效率;且 DNA 產物應保存在-20℃,以防 DNA 降解。為了提高 DNA 的回收量,可將離心得到的溶液重新加回離心吸附柱中,室溫放置 2 min,12,000 rpm(~13,400×g)離心 2 min,將 DNA 溶液收集到離心管。

通用型DNA純化回收試劑盒
基本售價:152.00元
儲存條件該試劑盒置于室溫(15-25℃)干燥條件下,可保存18個月,更長時間的保存可置于2-8℃。2-8℃保存條件下,若溶液產生沉淀,使用前應將試劑盒內的溶液在室溫放置一段時間,必要時可在37℃水浴中預熱10 min,以溶解沉淀。產品簡介及特性本試劑盒采用獨特的緩沖液體系和離心吸附柱,既能從TAE或TBE瓊脂糖凝膠中回收100 bp-20 kb大小的DNA片段,又能用于直接純化PCR產物,滿足多種實驗需要。整個純化過程可在15分鐘完成、不需進行苯酚萃取及酒精沉淀、純化的DNA無鹽類或大分子的污染。如果回收前DNA量為1-5ug,建議選用超薄DNA產物純化試劑盒GF203或超薄瓊脂糖凝膠回收試劑盒DF208,推薦洗脫液體積20-50ul。a.使用相同的溶液,可進行三種不同的應用(PCR 產物純化、DNA 產物純化、膠體回收)。b.每一離心管柱可處理達 150ul 的 DNA 溶液或 PCR 反應產物,DNA 回收率可達 80%~95%。c.可用于以 TAE 或 TBE 緩沖液配制的瓊脂糖凝膠的 DNA 回收,DNA 回收率可達 60~90%。注意事項1.電泳時應使用新的電泳緩沖液,以免影響電泳和回收效果。2.如下一步實驗要求較高,則應盡量使用 TAE 電泳緩沖液。3.切膠時,紫外照射時間應盡量短,以免對 DNA 造成損傷。4.洗脫緩沖液加量應根據回收前DNA量來決定:如回收前DNA只有1-5μg左右(推薦選用GF203或GF208超薄型試劑盒),加20-50μl洗脫液;如回收前有5-15μg左右DNA,加30-100μl洗脫緩沖液;如回收前有15-30μg左右DNA,加50-300μl洗脫緩沖液。5.回收率與初始 DNA 量和洗脫體積有關,初始量越少、洗脫體積越少,回收率越低。6.對于<100 bp 和>10 kb 的 DNA 片段可以適當的增加吸附和洗脫的時間。操作步驟使用前請先在漂洗液PW中加入無水乙醇,加入體積請參照瓶上的標簽。所有離心步驟均為使用臺式離心機在室溫下離心。一、從 PCR 反應液或酶切反應液中回收 DNA 1.完成 PCR 擴增或其他酶切反應操作后,移取反應混合液(含有預純化的 DNA)至干凈的離心管。 2.加入 3 倍體積的溶液 PC 至反應混合液中(如 50ul 反應混合液加入 150ul 的結合液),震蕩混合均勻。 3.將吸附柱放入收集管中,移取上一步混合液至吸附柱,室溫放置 2 min,以 12,000 rpm(~13,400×g )離心 1 分鐘,丟棄收集管中的懸液,將吸附柱 CB1 放回收集管中。 注意:若樣本體積超過 700ul,可分次加入并重復此步驟。 4.加入 700ul 的漂洗液至吸附柱中,靜置 1 分鐘以平衡管柱膜,于 12,000 rpm(~13,400×g )離心 1 分鐘,丟棄懸液,將吸附柱 CB1 放回收集管中。 5.重復操作步驟 4。 6.將吸附柱 CB1 放回收集管中,12,000 rpm(~13,400×g )離心 2 分鐘,將吸附柱開蓋置于室溫放置數分鐘,以去除、晾干殘余的漂洗液。 注意:漂洗液中乙醇的殘留會影響后續的酶切、PCR 等實驗 7.將吸附柱 CB1 置于一個干凈離心管中,向吸附膜中間位置懸空滴加適量的洗脫緩沖液 TB,室溫放置 2 min。12,000 rpm (~13,400×g )離心 2 min 收集 DNA 溶液。 注意:洗脫體積不應小于 30 μl,體積過少影響回收效率。洗脫液的 pH 值對于洗脫效率有較大影響,若后續做測序,需使用 ddH2O 做洗脫液,并保證其 pH 值在 7.0-8.5 范圍內,pH 值低于 7.0 會降低洗脫效率;且 DNA 產物應保存在-20°C,以防 DNA 降解。為了提高 DNA 的回收量,可將離心得到的溶液重新加回離心吸附柱中,室溫放置 2 min,12,000 rpm(~13,400×g)離心 2 min,將 DNA 溶液收集到離心管。 二、從瓊脂糖凝膠中回收 DNA 片段 1.完成電泳后,將單一的目的 DNA 條帶從瓊脂糖凝膠中切下(盡量切除多余部分)放入干凈的離心管中,稱取重量(如果凝膠重為 0.1 g,其體積可視為 100 μl)。 2.向膠塊中加入 2 倍體積(如果瓊脂糖凝膠濃度>2%,則加入 3 倍體積)的溶液 PC,60℃水浴孵育 5-15 min或更久,其間不斷溫和地上下翻轉離心管,直至膠塊充分溶解(若膠塊的體積過大,可事先將膠塊切成碎塊)。 注意:膠塊完全溶解后將膠溶液溫度降至室溫再上柱,因為吸附柱在室溫時結合 DNA 的能力較強。 3.將吸附柱放入收集管中,移取上一步溶膠液至吸附柱,以 12,000 rpm(~13,400×g )離心 1 分鐘,丟棄收集管中的濾液,將吸附柱 CB1 放回收集管中。 注意:若樣本體積超過 700ul,可分次加入并重復此步驟。 4.可選步驟:向吸附柱 CB1 加入 400ul 的溶液 PC,以 12,000 rpm(~13,400×g )離心 1 分鐘,丟棄收集管中的濾液,將吸附柱 CB1 放回收集管中(此步驟可去除殘余的瓊脂糖凝膠,以避免純化的 DNA 進行酶切反應時出現抑制現象)。 5.向吸附柱加入 700ul 的漂洗液,靜置 1 分鐘以平衡管柱膜,于 12,000 rpm(~13,400×g )離心 1 分鐘,丟棄濾液,將吸附柱 CB1 放回收集管中。 6.重復操作步驟 5。 7.將吸附柱 CB1 放回收集管中,12,000 rpm(~13,400×g )離心 2 分鐘,將吸附柱開蓋置于室溫放置數分鐘,以去除、晾干殘余的漂洗液。 注意:漂洗液中乙醇的殘留會影響后續的酶切、PCR 等實驗。 8.將吸附柱 CB1 置于一個干凈離心管中,向吸附膜中間位置懸空滴加適量洗脫液 TB,靜置 2 分鐘,室溫放置 2 min,12,000 rpm (~13,400×g )離心 2 min 收集 DNA 溶液。 注意:洗脫體積不應小于 30 μl,體積過少影響回收效率。洗脫液的 pH 值對于洗脫效率有較大影響,若后續做測序,需使用 ddH2O 做洗脫液,并保證其 pH 值在 7.0-8.5 范圍內,pH 值低于 7.0 會降低洗脫效率;且 DNA 產物應保存在-20℃,以防 DNA 降解。為了提高 DNA 的回收量,可將離心得到的溶液重新加回離心吸附柱中,室溫放置 2 min,12,000 rpm(~13,400×g)離心 2 min,將 DNA 溶液收集到離心管。

普通瓊脂糖凝膠DNA回收試劑盒
基本售價:784.00元
儲存條件該試劑盒置于室溫(15-25℃)干燥條件下,可保存18個月,更長時間的保存可置于2-8℃。2-8℃保存條件下,若溶液產生沉淀,使用前應將試劑盒內的溶液在室溫放置一段時間,必要時可在37℃水浴中預熱10 min,以溶解沉淀。產品簡介本試劑盒采用可以高效、專一結合DNA的硅基質材料和獨特的緩沖液系統,從TAE或TBE瓊脂糖凝膠上回收DNA片段,同時除去蛋白質、其它有機化合物、無機鹽離子及寡核苷酸引物等雜質。可回收100 bp-30kb大小的片段,回收率可達80%以上。每個離心吸附柱每次可吸附的DNA量為10 μg。使用本試劑盒回收的 DNA 可適用于各種常規操作,包括酶切、PCR、測序、文庫篩選、連接和轉化等實驗。如果回收前 DNA 量為 1-5ug,建議選用 DF208 超薄瓊脂糖凝膠回收 kit,推薦洗脫液體積 20-50ul。產品特點快速:整個操作過程快速方便,幾十分鐘即可完成回收工作。多樣:可以回收單鏈、雙鏈DNA片段以及環狀質粒DNA。高效:獨特的離心柱和精心配制的緩沖液,可大量回收到高純度的目的DNA。注意事項1.電泳時應使用新的電泳緩沖液,以免影響電泳和回收效果。2.如下一步實驗要求較高,則應盡量使用 TAE 電泳緩沖液。3.切膠時,紫外照射時間應盡量短,以免對 DNA 造成損傷。4.回收率與初始 DNA 量和洗脫體積有關,初始量越少、洗脫體積越少,回收率越低。5.對于<100 bp 和>10 kb 的 DNA 片段可以適當的增加吸附和洗脫的時間。操作步驟使用前請先在漂洗液PW中加入無水乙醇,加入體積請參照瓶上的標簽。所有離心步驟均為使用臺式離心機在室溫下離心。1.完成電泳后,將單一的目的 DNA 條帶從瓊脂糖凝膠中切下(盡量切除多余部分)放入干凈的離心管中,稱取重量(如果凝膠重為 0.1 g,其體積可視為 100 μl)。2.向膠塊中加入 2 倍體積(如果瓊脂糖凝膠濃度>2%,則加入 3 倍體積)的溶液 PN,60℃水浴孵育 5-15 min或更久,其間不斷溫和地上下翻轉離心管,直至膠塊充分溶解(若膠塊的體積過大,可事先將膠塊切成碎 塊)。 注意:膠塊完全溶解后將膠溶液溫度降至室溫再上柱,因為吸附柱在室溫時結合 DNA 的能力較強。 3.將吸附柱 CB2 放入收集管中,移取上一步溶膠液至吸附柱,室溫放置 2 min,以 12,000 rpm(~13,400×g )離心 1 分鐘,丟棄收集管中的濾液,將吸附柱 CB2 放回收集管中。 注意:若樣本體積超過 700ul,可分次加入并重復此步驟。 4.可選步驟:向吸附柱 CB2 加入 400ul 的溶液 PN,以 12,000 rpm(~13,400×g )離心 1 分鐘,丟棄收集管中的濾液,將吸附柱 CB2 放回收集管中(此步驟可去除殘余的瓊脂糖凝膠,以避免純化的 DNA 進行酶切反應時出現抑制現象)。 5.向吸附柱 CB2 加入 700ul 的漂洗液,靜置 1 分鐘以平衡管柱膜,于 12,000 rpm(~13,400×g )離心 1 分鐘,丟棄濾液,將吸附柱 CB2 放回收集管中。 6.重復操作步驟 5。 7.將吸附柱 CB2 放回收集管中,12,000 rpm(~13,400×g )離心 2 分鐘,將吸附柱開蓋置于室溫放置數分鐘,以去除、晾干殘余的漂洗液。 注意:漂洗液中乙醇的殘留會影響后續的酶反應(酶切、PCR 等)實驗。 8.將吸附柱 CB2 置于一個干凈離心管中,向吸附膜中間位置懸空滴加 30-100ul 洗脫緩沖液 TB,室溫放置 2min。12,000 rpm (~13,400×g )離心 2 min 收集 DNA 溶液。 注意:洗脫體積不應小于 30 μl,體積過少影響回收效率。洗脫液的 pH 值對于洗脫效率有較大影響,若后續做測序,需使用 ddH2O 做洗脫液,并保證其 pH 值在 7.0-8.5 范圍內,pH 值低于 7.0 會降低洗脫效率;且 DNA 產物應保存在-20°C,以防 DNA 降解。為了提高 DNA 的回收量,可將離心得到的溶液重新加回離心吸附柱中,室溫放置 2 min,12,000 rpm(~13,400×g)離心 2 min,將 DNA 溶液收集到離心管。

普通瓊脂糖凝膠DNA回收試劑盒
基本售價:216.00元
儲存條件該試劑盒置于室溫(15-25℃)干燥條件下,可保存18個月,更長時間的保存可置于2-8℃。2-8℃保存條件下,若溶液產生沉淀,使用前應將試劑盒內的溶液在室溫放置一段時間,必要時可在37℃水浴中預熱10 min,以溶解沉淀。產品簡介本試劑盒采用可以高效、專一結合DNA的硅基質材料和獨特的緩沖液系統,從TAE或TBE瓊脂糖凝膠上回收DNA片段,同時除去蛋白質、其它有機化合物、無機鹽離子及寡核苷酸引物等雜質。可回收100 bp-30kb大小的片段,回收率可達80%以上。每個離心吸附柱每次可吸附的DNA量為10 μg。使用本試劑盒回收的 DNA 可適用于各種常規操作,包括酶切、PCR、測序、文庫篩選、連接和轉化等實驗。如果回收前 DNA 量為 1-5ug,建議選用 DF208 超薄瓊脂糖凝膠回收 kit,推薦洗脫液體積 20-50ul。產品特點快速:整個操作過程快速方便,幾十分鐘即可完成回收工作。多樣:可以回收單鏈、雙鏈DNA片段以及環狀質粒DNA。高效:獨特的離心柱和精心配制的緩沖液,可大量回收到高純度的目的DNA。注意事項1.電泳時應使用新的電泳緩沖液,以免影響電泳和回收效果。2.如下一步實驗要求較高,則應盡量使用 TAE 電泳緩沖液。3.切膠時,紫外照射時間應盡量短,以免對 DNA 造成損傷。4.回收率與初始 DNA 量和洗脫體積有關,初始量越少、洗脫體積越少,回收率越低。5.對于<100 bp 和>10 kb 的 DNA 片段可以適當的增加吸附和洗脫的時間。操作步驟使用前請先在漂洗液PW中加入無水乙醇,加入體積請參照瓶上的標簽。所有離心步驟均為使用臺式離心機在室溫下離心。1.完成電泳后,將單一的目的 DNA 條帶從瓊脂糖凝膠中切下(盡量切除多余部分)放入干凈的離心管中,稱取重量(如果凝膠重為 0.1 g,其體積可視為 100 μl)。2.向膠塊中加入 2 倍體積(如果瓊脂糖凝膠濃度>2%,則加入 3 倍體積)的溶液 PN,60℃水浴孵育 5-15 min或更久,其間不斷溫和地上下翻轉離心管,直至膠塊充分溶解(若膠塊的體積過大,可事先將膠塊切成碎 塊)。 注意:膠塊完全溶解后將膠溶液溫度降至室溫再上柱,因為吸附柱在室溫時結合 DNA 的能力較強。 3.將吸附柱 CB2 放入收集管中,移取上一步溶膠液至吸附柱,室溫放置 2 min,以 12,000 rpm(~13,400×g )離心 1 分鐘,丟棄收集管中的濾液,將吸附柱 CB2 放回收集管中。 注意:若樣本體積超過 700ul,可分次加入并重復此步驟。 4.可選步驟:向吸附柱 CB2 加入 400ul 的溶液 PN,以 12,000 rpm(~13,400×g )離心 1 分鐘,丟棄收集管中的濾液,將吸附柱 CB2 放回收集管中(此步驟可去除殘余的瓊脂糖凝膠,以避免純化的 DNA 進行酶切反應時出現抑制現象)。 5.向吸附柱 CB2 加入 700ul 的漂洗液,靜置 1 分鐘以平衡管柱膜,于 12,000 rpm(~13,400×g )離心 1 分鐘,丟棄濾液,將吸附柱 CB2 放回收集管中。 6.重復操作步驟 5。 7.將吸附柱 CB2 放回收集管中,12,000 rpm(~13,400×g )離心 2 分鐘,將吸附柱開蓋置于室溫放置數分鐘,以去除、晾干殘余的漂洗液。 注意:漂洗液中乙醇的殘留會影響后續的酶反應(酶切、PCR 等)實驗。 8.將吸附柱 CB2 置于一個干凈離心管中,向吸附膜中間位置懸空滴加 30-100ul 洗脫緩沖液 TB,室溫放置 2min。12,000 rpm (~13,400×g )離心 2 min 收集 DNA 溶液。 注意:洗脫體積不應小于 30 μl,體積過少影響回收效率。洗脫液的 pH 值對于洗脫效率有較大影響,若后續做測序,需使用 ddH2O 做洗脫液,并保證其 pH 值在 7.0-8.5 范圍內,pH 值低于 7.0 會降低洗脫效率;且 DNA 產物應保存在-20°C,以防 DNA 降解。為了提高 DNA 的回收量,可將離心得到的溶液重新加回離心吸附柱中,室溫放置 2 min,12,000 rpm(~13,400×g)離心 2 min,將 DNA 溶液收集到離心管。

大量DNA產物純化試劑盒
基本售價:240.00元
儲存條件 該試劑盒置于室溫(15-25℃)干燥條件下,可保存18個月,更長時間的保存可置于2-8℃。2-8℃保存條件下,若溶液產生沉淀,使用前應將試劑盒內的溶液在室溫放置一段時間,必要時可在37℃水浴中預熱10 min,以溶解沉淀。 產品簡介 本試劑盒采用獨特的離心吸附柱純化酶切、PCR等反應溶液中的DNA片段,同時除去蛋白質、其它有機化合物、無機鹽離子及寡核苷酸引物等雜質,回收100 bp-20 kb DNA片段,回收率可達80%以上。每個離心吸附柱每次可吸附的DNA量為20μg。使用本試劑盒回收的DNA可適用于各種常規操作,包括酶切、PCR、測序、文庫篩選、連接和轉化等實驗。 產品特點 快速:整個操作過程只需十幾分鐘,節省時間。 多樣:可以回收單鏈、雙鏈DNA片段以及環狀質粒DNA。 高效:獨特的離心柱和精心配制的緩沖液,可大量回收到高純度目的DNA。 注意事項 1.本試劑盒適用于無選擇性的回收溶液中所有 DNA 片段,如需選擇性回收特定片段,同時去除其他不同大小片段,請選擇膠回收試劑盒。 2.回收率與初始 DNA 量和洗脫體積有關,初始量越少、洗脫體積越少,回收率越低。 3.對于<100 bp 和>10 kb 的 DNA 片段可以適當的增加吸附和洗脫的時間。 操作步驟 使用前請先在漂洗液PW中加入無水乙醇,加入體積請參照瓶上的標簽;所有離心步驟均為使用臺式離 心機在室溫下離心。 1.完成 PCR 擴增或其他酶切反應操作后,移取反應混合液(含有預純化的 DNA)至干凈的離心管。 2.加入 3 倍體積的溶液 PB 至反應混合液中(如 50ul 反應混合液加入 150ul 的結合液),震蕩混合均勻。 3.將吸附柱 CB1 放入收集管中,移取上一步混合液至吸附柱,室溫放置 2 min,以 12,000 rpm(~13,400×g ) 離心 1 分鐘,丟棄收集管中的懸液,將吸附柱 CB1 放回收集管中。 注意:若樣本體積超過 700ul,可分次加入并重復此步驟。 4.向吸附柱 CB1 中加入 700ul 的漂洗液,靜置 1 分鐘以平衡管柱膜,于 12,000 rpm(~13,400×g )離心 1 分鐘,丟棄懸液,將吸附柱 CB1 放回收集管中。 5.重復操作步驟 4。 6.將吸附柱 CB1 放回收集管中,12,000 rpm(~13,400×g )離心 2 分鐘,將吸附柱開蓋置于室溫放置數分鐘,以去除、晾干殘余的漂洗液。 注意:漂洗液中乙醇的殘留會影響后續的酶反應(酶切、PCR 等)實驗。 7.將吸附柱 CB1 置于一個干凈離心管中,向吸附膜中間位置懸空滴加適量 50-300ul 洗脫緩沖液 TB,室溫放置 2 min。12,000 rpm (~13,400×g )離心 2 min 收集 DNA 溶液。 注意:洗脫體積不應小于 50 μl,體積過少影響回收效率。洗脫液的 pH 值對于洗脫效率有較大影響,若后續做測序,需使用 ddH2O 做洗脫液,并保證其 pH 值在 7.0-8.5 范圍內,pH 值低于 7.0 會降低洗脫效率;且 DNA 產物應保存在-20℃,以防 DNA 降解。為了提高 DNA 的回收量,可將離心得到的溶液重新加回離心吸附柱中,室溫放置 2 min,12,000 rpm(~13,400×g)離心 2 min,將 DNA 溶液收集到離心管。

普通DNA產物純化試劑盒
基本售價:688.00元
儲存條件 該試劑盒置于室溫(15-25℃)干燥條件下,可保存18個月,更長時間的保存可置于2-8℃。2-8℃保存條件下,若溶液產生沉淀,使用前應將試劑盒內的溶液在室溫放置一段時間,必要時可在37℃水浴中預熱10 min,以溶解沉淀。 產品簡介 本試劑盒采用獨特的離心吸附柱純化酶切、PCR等反應溶液中的DNA片段,同時除去蛋白質、其它有機化合物、無機鹽離子及寡核苷酸引物等雜質,回收100 bp-20 kb DNA片段,回收率可達80%以上。每個離心吸附柱每次可吸附的DNA量為10 μg。使用本試劑盒回收的DNA可適用于各種常規操作,包括酶切、PCR、測序、文庫篩選、連接和轉化等實驗。 如果回收前DNA量為1-5ug,建議選用GF203超薄DNA產物純化kit,推薦洗脫液體積20-50ul。 產品特點 快速:整個操作過程只需十幾分鐘,節省時間。 多樣:可以回收單鏈、雙鏈DNA片段以及環狀質粒DNA。 高效:獨特的離心柱和精心配制的緩沖液,可大量回收到高純度目的DNA。 注意事項 1.本試劑盒適用于無選擇性的回收溶液中所有 DNA 片段,如需選擇性回收特定片段,同時去除其他不同大小片段,請選擇膠回收試劑盒。 2.回收率與初始 DNA 量和洗脫體積有關,初始量越少、洗脫體積越少,回收率越低。 3.對于<100 bp 和>10 kb 的 DNA 片段可以適當的增加吸附和洗脫的時間。 操作步驟 使用前請先在漂洗液PW中加入無水乙醇,加入體積請參照瓶上的標簽;所有離心步驟均為使用臺式離心機在室溫下離心。 1.完成 PCR 擴增或其他酶切反應操作后,移取反應混合液(含有預純化的 DNA)至干凈的離心管。 2.加入 3 倍體積的溶液 PB 至反應混合液中(如 50ul 反應混合液加入 150ul 的結合液),震蕩混合均勻。 3.將吸附柱放入收集管中,移取上一步混合液至吸附柱,室溫放置 2 min,以 12,000 rpm(~13,400×g )離心 1 分鐘,丟棄收集管中的懸液,將吸附柱 CB2 放回收集管中。 注意:若樣本體積超過 700ul,可分次加入并重復此步驟。 4.向吸附柱 CB2 加入 700ul 的漂洗液,靜置 1 分鐘以平衡管柱膜,于 12,000 rpm(~13,400×g )離心 1 分鐘,丟棄懸液,將吸附柱 CB2 放回收集管中。 5.重復操作步驟 4。 6.將吸附柱 CB2 放回收集管中,12,000 rpm(~13,400×g )離心 2 分鐘,將吸附柱開蓋置于室溫放置數分鐘,以去除、晾干殘余的漂洗液。 注意:漂洗液中乙醇的殘留會影響后續的酶反應(酶切、PCR 等)實驗。 7.將吸附柱CB2置于一個干凈離心管中,向吸附膜中間位置懸空滴加30-100洗脫緩沖液TB,室溫放置2 min。12,000 rpm (~13,400×g )離心 2 min 收集 DNA 溶液。 注意:洗脫體積不應小于 30 μl。洗脫液的 pH 值對于洗脫效率有較大影響,若后續做測序,需使用 ddH2O做洗脫液,并保證其 pH 值在 7.0-8.5 范圍內,pH 值低于 7.0 會降低洗脫效率;為了提高 DNA 的回收量,可將離心得到的溶液重新加回離心吸附柱中,室溫放置 2 min,12,000 rpm(~13,400×g)離心 2 min,將 DNA溶液收集到離心管。

超薄DNA產物純化試劑盒
基本售價:240.00元
儲存條件該試劑盒置于室溫(15-25℃)干燥條件下,可保存18個月,更長時間的保存可置于2-8℃。2-8℃保存條件下,若溶液產生沉淀,使用前應將試劑盒內的溶液在室溫放置一段時間,必要時可在37℃水浴中預熱10 min,以溶解沉淀。產品簡介本試劑盒采用獨特的離心吸附柱純化酶切、PCR等反應溶液中的DNA片段,同時除去蛋白質、其它有機化合物、無機鹽離子及寡核苷酸引物等雜質,回收100 bp-10 kb DNA片段,回收率可達80%以上,可用最少20ul的洗脫液進行洗脫,每個離心吸附柱每次可吸附的DNA量為5 μg,特別適用于較少樣品量的回收。使用本試劑盒回收的DNA可適用于各種常規操作,包括酶切、PCR、測序、文庫篩選、連接和轉化等實驗。產品特點快速:整個操作過程只需十幾分鐘,節省時間。多樣:可以回收單鏈、雙鏈DNA片段以及環狀質粒DNA。高效:獨特的離心柱和精心配制的緩沖液,可大量回收到高純度目的DNA。注意事項1.本試劑盒適用于無選擇性的回收溶液中所有 DNA 片段,如需選擇性回收特定片段,同時去除其他不同大小片段,請選擇膠回收試劑盒。2.回收率與初始 DNA 量和洗脫體積有關,初始量越少、洗脫體積越少,回收率越低。3.對于<100 bp 和>10 kb 的 DNA 片段可以適當的增加吸附和洗脫的時間。操作步驟使用前請先在漂洗液PW中加入無水乙醇,加入體積請參照瓶上的標簽;所有離心步驟均為使用臺式離心機在室溫下離心。1.完成 PCR 擴增或其他酶切反應操作后,移取反應混合液(含有預純化的 DNA)至干凈的離心管。2.加入 3 倍體積的溶液 PB 至反應混合液中(如 50ul 反應混合液加入 150ul 的結合液),震蕩混合均勻。3.將吸附柱放入收集管中,移取上一步混合液至吸附柱,室溫放置 2 min,以 12,000 rpm(~13,400×g )離心 1 分鐘,丟棄收集管中的懸液,將吸附柱 CB3 放回收集管中。注意:若樣本體積超過 700ul,可分次加入并重復此步驟。 4.向吸附柱 CB3 加入 700ul 的漂洗液 PW,靜置 1 分鐘以平衡管柱膜,于 12,000 rpm(~13,400×g )離心 1分鐘,丟棄懸液,將吸附柱 CB3 放回收集管中。 5.重復操作步驟 4。 6.將吸附柱 CB3 放回收集管中,12,000 rpm(~13,400×g )離心 2 分鐘,將吸附柱開蓋置于室溫放置數分鐘,以去除、晾干殘余的漂洗液。 注意:漂洗液中乙醇的殘留會影響后續的酶反應(酶切、PCR 等)實驗。 7.將吸附柱 CB3 置于一個干凈離心管中,向吸附膜中間位置懸空滴加 20-50ul 洗脫緩沖液 TB,室溫放置 2min。12,000 rpm (~13,400×g )離心 2 min 收集 DNA 溶液。 注意:洗脫體積最低不應小于 20 μl,體積過少會影響回收的效率。洗脫液的 pH 值對于洗脫效率有較大影響,若后續做測序,需使用 ddH2O 做洗脫液,并保證其 pH 值在 7.0-8.5 范圍內,pH 值低于 7.0 會降低洗脫效率;且 DNA 產物應保存在-20℃,以防止 DNA 降解。為了提高 DNA 的回收量,可將離心得到的溶液重新加回離心吸附柱中,再次離心管。

無內毒素質粒小提中量試劑盒
基本售價:464.00元
儲存條件 本試劑盒在室溫(15-25℃)干燥條件下,可保存12個月;更長時間的保存可置于2-8℃。(注意:當低溫貯存時,使用前應先將試劑盒內的溶液在室溫中放置一段時間,必要時可在37℃水浴中預熱10 min,以平衡溶液溫度)。單獨包裝的RNase A在室溫可穩定保存12個月以上。加入RNase A后的溶液P1應置于2-8℃保存,可穩定保存6個月。產品簡介 本試劑盒采用獨特的硅膠膜吸附技術,高效專一地結合質粒DNA。同時采用特殊的去內毒素溶液ER和過濾柱CS1,可有效的去除內毒素、蛋白等雜質;整個提取過程僅需1個小時,方便快捷。以下操作步驟適用于提取5-15 ml過夜培養的大腸桿菌,質粒提取得率和質量與宿主菌的種類和培養條件,細胞的裂解,質粒拷貝數,質粒的穩定性,抗生素等因素有關。使用本試劑盒提取的質粒DNA可適用于轉染多種細胞及各種常規操作,包括酶切、PCR、測序、連接等實驗。注意事項 請務必在使用本試劑盒之前閱讀此注意事項。 1.溶液 P1 在使用前先加入 RNase A(將試劑盒中提供的 RNase A 全部加入),混勻,置于 2-8℃保存。2.使用前先檢查溶液 P2 和 P3 是否出現渾濁,如有混濁現象,可在 37℃水浴中加熱幾分鐘,即可恢復澄清。3.所有離心步驟均為使用臺式離心機室溫下進行離心,速度為 12,000 rpm (~13,400×g )。4.去內毒素溶液 ER 在多次開蓋使用后,可能會有細微的顏色變化,不影響最終質粒提取效率和純度。5.提取的質粒量與細菌培養濃度、質粒拷貝數等因素有關。如果所提質粒為低拷貝質粒或大于 10 kb 的大質粒,應加大菌體使用量,同時按比例增加 P1、P2、P3 的用量,洗脫緩沖液應在 65-70℃預熱。可以適當的延長吸附和洗脫的時間,以增加提取效率。操作步驟 使用前請先在漂洗液PW中加入無水乙醇,加入體積請參照瓶上的標簽。 本產品僅供科研使用,請勿用于臨床診斷及其它用途1.取5-15 ml過夜培養的菌液加入離心管中,12,000 rpm (~13,400×g ) 離心1 min,盡量吸除上清。注意:菌液較多時可以通過幾次離心將菌體沉淀收集到一個離心管中, 菌體量以能夠充分裂解為佳,過多的菌體裂解不充分會降低質粒的提取效率。 2.向留有菌體沉淀的離心管中加入500 μl溶液P1 (請先檢查是否已加入RNaseA),使用移液器吸吐或渦旋振蕩器徹底懸浮細菌細胞沉淀。注意:請務必徹底懸浮細菌沉淀,如果有未徹底混勻的菌塊,會影響裂解,導致提取量和純度偏低。 3.向離心管中加入500 μl溶液P2,溫和地上下翻轉6-8次使菌體充分裂解。注意:溫和地混合,不要劇烈震蕩,以免污染基因組DNA。此時菌液應變得清亮粘稠,所用時間不應超過5 min,以免質粒受到破壞。如果未變得清亮,可能由于菌體過多,裂解不徹底,應減少菌體量。 4.向離心管中加入500 μl溶液P3,立即溫和地上下翻轉6-8次,充分混勻,此時會出現白色絮狀沉淀,然后室溫放置10 min左右,12,000 rpm (~13,400×g ) 離心10 min,此時在離心管底部形成沉淀。注意:P3加入后應立即混合,避免產生局部沉淀。如果上清中還有微小白色沉淀,可再次離心后取上清。 5.將上一步收集的上清液分次加入過濾柱CS1(過濾柱放入收集管中),12,000 rpm(~13,400×g ) 離心2min,小心地將過濾離心后收集管中得到的溶液分次加入吸附柱CP2中(吸附柱放入收集管中),(如果過濾柱中有殘余的液體,說明步驟4的上清中雜質過多,可以延長離心的時間;如果離心后收集管底部有少量的沉淀,盡量地吸取上清)。6.12,000 rpm (~13,400×g ) 離心1 min,倒掉收集管中的廢液,將吸附柱CP2放入收集管中。7.向吸附柱CP2加入750 ml 去內毒素溶液ER(已經加入異丙醇),靜置2分鐘使管柱膜平衡,室溫12,000rpm (~13,400×g)離心1 min,倒掉收集管中的廢液,將吸附柱重新放回收集管中。8.向吸附柱CP2中加入700 μl漂洗液PW(請先檢查是否已加入無水乙醇),12,000 rpm(~13,400×g ) 離心1 min,倒掉收集管中的廢液,將吸附柱CP2放入收集管中。注意:加入漂洗液PW后,如果室溫靜置2-5 min,有助于更好地去除雜質。 9.重復操作步驟8.10.將吸附柱CP2重新放回收集管中,12,000 rpm (~13,400×g ) 離心2 min,目的是將吸附柱中殘余的漂洗液去除。注意:漂洗液中乙醇的殘留會影響后續的酶反應(酶切、PCR等)實驗。為確保下游實驗不受殘留乙醇的影響,建議將吸附柱CP2開蓋,置于室溫放置數分鐘,以徹底晾干吸附材料中殘余的乙醇。 11.將吸附柱CP2置于一個干凈的離心管中,向吸附膜的中間部位懸空滴加100-300 μl洗脫緩沖液TB,室溫放置2 min,12,000 rpm (~13,400×g ) 離心1 min將質粒溶液收集到離心管中。注意:洗脫緩沖液體積不應少于100μl,體積過小影響回收效率。洗脫液的pH值對于洗脫效率有很大影響,若后續做測序,需使用ddH2O做洗脫液,并保證其pH值在7.0-8.5范圍內,pH值低于7.0會降低洗脫效率。且DNA產物應保存在-20℃,以防DNA降解。為了增加質粒的回收率,可將得到的溶液重新加入吸附柱中,室溫放置2 min,12,000 rpm(~13,400×g) 離心2 min,將質粒溶液收集到離心管中。

質粒小提中量試劑盒
基本售價:240.00元
儲存條件該試劑盒置于室溫(15-25℃)干燥條件下,可保存12個月,更長時間的保存可置于2-8℃。2-8℃保存條件下,若溶液產生沉淀,使用前應將試劑盒內的溶液在室溫放置一段時間,必要時可在37℃水浴中預熱10 min,以溶解沉淀。第一次使用前將RNase A加入溶液P1中,混勻后置于2-8℃保存,可穩定保存12個月以上。單獨包裝的RNase A 在室溫可穩定保存12個月以上。產品簡介本試劑盒采用堿裂解法裂解細胞,通過離心吸附柱在高鹽狀態下特異性地結合溶液中的DNA。離心吸附柱中采用的硅基質材料為本公司新型材料,高效、專一吸附DNA,可去除雜質蛋白及細胞中其他有機化合物。以下操作步驟適用于提取5-15 ml過夜培養的大腸桿菌,質粒提取得率和質量與宿主菌的種類和培養條件,細胞的裂解,質粒拷貝數,質粒的穩定性,抗生素等因素有關。使用本試劑盒提取的質粒DNA可適用于各種常規操作,包括酶切、PCR、測序、連接、轉化、文庫篩選、體外翻譯、轉染一些常規的傳代細胞等。注意事項 請務必在使用本試劑盒之前閱讀此注意事項。1.溶液 P1 在使用前先加入 RNase A(將試劑盒中提供的 RNase A 全部加入),混勻,置于 2-8℃保存。2.使用前先檢查溶液 P2 和 P3 是否出現渾濁,如有混濁現象,可在 37℃水浴中加熱幾分鐘,即可恢復澄清。3.注意不要直接接觸溶液 P2 和 P3,使用后應立即蓋緊蓋子。4.所有離心步驟均為使用臺式離心機室溫下進行離心,速度為 12,000 rpm (~13,400×g )。5.提取的質粒量與細菌培養濃度、質粒拷貝數等因素有關。如果所提質粒為低拷貝質粒或大于 10 kb 的大質粒,應加大菌體使用量,同時按比例增加 P1、P2、P3 的用量,洗脫緩沖液應在 65-70℃預熱。可以適當的延長吸附和洗脫的時間,以增加提取效率。操作步驟使用前請先在漂洗液PW中加入無水乙醇,加入體積請參照瓶上的標簽。1.取5-15 ml過夜培養的菌液加入離心管中,12,000 rpm (~13,400×g )離心1 min,盡量吸除上清。注意:菌液較多時可以通過幾次離心將菌體沉淀收集到一個離心管中。收集的菌體量以能夠充分裂解為佳,菌體過多裂解不充分會降低質粒的提取效率。 2.向留有菌體沉淀的離心管中加入500 μl溶液P1(請先檢查是否已加入RNase A),使用移液器吸吐或渦旋振蕩器徹底懸浮細菌細胞沉淀。 注意:如果有未徹底混勻的菌塊,會影響裂解,導致提取量和純度偏低。 3.向離心管中加入500 μl溶液P2,溫和地上下翻轉6-8次使菌體充分裂解。 注意:溫和地混合,不要劇烈震蕩,以免污染基因組DNA。此時菌液應變得清亮粘稠,所用時間不應超過5min,以免質粒受到破壞。如果菌液沒有變清亮,可能是由于菌體過多,裂解不徹底,應減少菌體量。 4.向離心管中加入500 μl溶液P3,立即溫和地上下翻轉6-8次,充分混勻,此時會出現白色絮狀沉淀。12,000 rpm (~13,400×g ) 離心10 min,此時在離心管底部形成沉淀。 注意:P3加入后應立即混合,避免產生局部沉淀。如果上清中還有微小白色沉淀,可再次離心后取上清。 5.將上一步收集的上清液分次加入吸附柱CP2中(吸附柱放入收集管中,其容量為750-800ul),注意盡量不要吸出沉淀。12,000 rpm (~13,400×g )離心1 min,倒掉收集管中的廢液,將吸附柱CP2放入收集管中。 6.向吸附柱CP2中加入700 μl漂洗液PW(請先檢查是否已加入無水乙醇),12,000 rpm(~13,400×g )離心1 min,倒掉收集管中的廢液,將吸附柱CP2放入收集管中。 7.重復操作步驟6。 8.吸附柱CP2放入收集管中,12,000 rpm(~13,400×g )離心2 min,目的是將吸附柱中殘余的漂洗液去除。 注意:漂洗液中乙醇的殘留會影響后續的酶反應(酶切、PCR等)實驗。為確保下游實驗不受殘留乙醇的影響,建議將吸附柱CP2開蓋,置于室溫放置數分鐘,以徹底晾干吸附材料中殘余的乙醇。 9.將吸附柱CP2置于一個干凈的離心管中,向吸附膜的中間部位懸空滴加100-300 μl洗脫緩沖液TB,室溫放置2-5 min,12,000 rpm(~13,400×g )離心2 min,將質粒溶液收集到離心管中。 注意:洗脫緩沖液體積不應少于100μl,體積過小影響回收效率。洗脫液的pH值對于洗脫效率有很大影響,若后續做測序,需使用ddH2O做洗脫液,并保證其pH值在7.0-8.5范圍內,pH值低于7.0會降低洗脫效率。且DNA產物應保存在-20℃,以防DNA降解。為了增加質粒的回收率,可將得到的溶液重新加入吸附柱中,室溫放置2 min,12,000 rpm(~13,400×g) 離心2min,將質粒溶液收集到離心管中。

高純度質粒小提試劑盒
基本售價:240.00元
儲存條件 該試劑盒置于室溫(15-25℃)干燥條件下,可保存12個月,更長時間的保存可置于2-8℃。2-8℃保存條件下,若溶液產生沉淀,使用前應將試劑盒內的溶液在室溫放置一段時間,必要時可在37℃水浴中預熱10 min,以溶解沉淀。第一次使用前將RNase A加入溶液P1中,混勻后置于2-8℃保存,可穩定保存12個月以上。單獨包裝的RNase A 在室溫可穩定保存12個月以上。 產品簡介 本試劑盒采用堿裂解法裂解細胞,再通過離心吸附柱在高鹽狀態下特異性地結合溶液中的DNA。離心吸附柱中采用的硅基質材料為本公司新型材料,高效、專一吸附DNA。由于增加了過濾柱,與普通的提取方法相比,本試劑盒可去除雜質蛋白及細胞中其他有機化合物,適用于提取1-5 ml過夜培養的大腸桿菌,質粒提取得率和質量與宿主菌的種類和培養條件,細胞的裂解,質粒拷貝數,質粒的穩定性,抗生素等因素有關。 使用本試劑盒提取的質粒DNA可適用于轉染多種細胞及各種常規操作,包括酶切、PCR、測序、連接等實驗。 注意事項 請務必在使用本試劑盒之前閱讀此注意事項。 1.溶液 P1 在使用前先加入 RNase A(將試劑盒中提供的 RNase A 全部加入),混勻,置于 2-8℃保存。 2.使用前先檢查溶液 P2 和 P3 是否出現渾濁,如有混濁現象,可在 37℃水浴中加熱幾分鐘,即可恢復澄清。 3.注意不要直接接觸溶液 P2 和 P3,使用后應立即蓋緊蓋子。 4.所有離心步驟均為使用臺式離心機室溫下進行離心,速度為 12,000 rpm (~13,400×g)。 5.提取的質粒量與細菌培養濃度、質粒拷貝數等因素有關。 操作步驟 使用前請先在漂洗液PW中加入無水乙醇,加入體積請參照瓶上的標簽。 1.取1-5 ml過夜培養的菌液加入離心管中,12,000 rpm (~13,400×g )離心1 min,盡量吸除上清(菌液較多時可以通過幾次離心將菌體沉淀收集到一個離心管中)。 2.向留有菌體沉淀的離心管中加入250 μl溶液P1 (請先檢查是否已加入RNase A),使用移液器吸吐或渦旋振蕩器徹底懸浮細菌細胞沉淀。 注意:如果有未徹底混勻的菌塊,會影響裂解,導致提取量和純度偏低。 3.向離心管中加入250 μl溶液P2,溫和地上下翻轉6-8次使菌體充分裂解。 注意:溫和地混合,不要劇烈震蕩,以免打斷基因組DNA,造成提取的質粒中混有基因組DNA片斷。此時菌液應變得清亮粘稠,所用時間不應超過5 min,以免質粒受到破壞。如果未變得清亮,可能由于菌體過多,裂解不徹底,應減少菌體量。 4.向離心管中加入250 μl溶液P3,立即溫和地上下翻轉6-8次,充分混勻,此時會出現白色絮狀沉淀。12,000 rpm (~13,400×g ) 離心10 min,用移液器小心地將上清轉移到過濾柱CS1(過濾柱放入收集管中),注意盡量不要吸出沉淀。 注意:P3加入后應立即混合,避免產生局部沉淀。如果上清中還有微小白色沉淀,可再次離心后取上清。 5.12,000 rpm (~13,400×g )離心2 min,小心地將離心后收集管中得到的溶液轉移到吸附柱CP1中(吸附柱放入收集管中),(如果過濾柱中有殘余的液體說明步驟4吸取的上清中雜質過多,可以延長離心的時間; 如果離心后收集管底部有少量的沉淀,盡量的吸取上清)。 6.12,000 rpm (~13,400×g ) 離心30-60 sec,倒掉收集管中的廢液,將吸附柱CP1放入收集管中。 7.向吸附柱CP1中加入700 μl漂洗液PW(請先檢查是否已加入無水乙醇),12,000 rpm(~13,400×g ) 離心30-60 sec,倒掉收集管中的廢液,將吸附柱CP1放入收集管中。 8.重復操作步驟7。 9.將吸附柱CP1放入收集管中,12,000 rpm (~13,400×g ) 離心2 min,目的是將吸附柱中殘余的漂洗液去除。 注意:漂洗液中乙醇的殘留會影響后續的酶反應(酶切、PCR等)實驗。為確保下游實驗不受殘留乙醇的影響,建議將吸附柱CP1開蓋,置于室溫放置數分鐘,以徹底晾干吸附材料中殘余的乙醇。 10.將吸附柱CP1置于一個干凈的離心管中,向吸附膜的中間部位滴加50-100 μl洗脫緩沖液TB,室溫放置2 min,12,000 rpm (~13,400×g) 離心2 min將質粒溶液收集到離心管中。 注意:洗脫緩沖液體積不應少于50μl,體積過小影響回收效率。洗脫液的pH值對于洗脫效率有很大影響,若后續做測序,需使用ddH2O做洗脫液,并保證其pH值在7.0-8.5范圍內,pH值低于7.0會降低洗脫效率。且DNA產物應保存在-20℃,以防DNA降解。為了增加質粒的回收率,可將得到的溶液重新加入吸附柱中,室溫放置2 min,12,000 rpm(~13,400×g) 離心2 min,將質粒溶液收集到離心管中。 低拷貝或大質粒( >10kb)提取 如果所提質粒為低拷貝質粒或大于10 kb的大質粒,應加大菌體使用量,使用5-10 ml過夜培養物,同時按照比例增加P1、P2、P3的用量,洗脫緩沖液TB應在65-70℃水浴預熱,在吸附和洗脫時可以適當的延長時間,以增加提取效率。其它步驟相同。

質粒小提試劑盒-200次
基本售價:544.00元
儲存條件 該試劑盒置于室溫(15-25℃)干燥條件下,可保存12個月,更長時間的保存可置于2-8℃。2-8℃保存條件下,若溶液產生沉淀,使用前應將試劑盒內的溶液在室溫放置一段時間,必要時可在37℃水浴中預熱10 min,以溶解沉淀。第一次使用前將RNase A加入溶液P1中,混勻后置于2-8℃保存,可穩定保存12個月以上。單獨包裝的RNase A 在室溫可穩定保存12個月以上。 產品簡介 本試劑盒采用堿裂解法裂解細胞,再通過離心吸附柱在高鹽狀態下特異性地結合溶液中的DNA。離心吸附柱中采用的硅基質材料為本公司新型材料,高效、專一吸附DNA。以下操作步驟適用于提取1-5ml過夜培養的大腸桿菌,質粒提取得率和質量與宿主菌的種類和培養條件,細胞的裂解,質粒拷貝數,質粒的穩定性,抗生素等因素有關。 使用本試劑盒提取的質粒DNA可適用于各種常規操作,包括酶切、PCR、測序、連接、轉化、文庫篩選、體外翻譯、轉染一些常規的傳代細胞等。 注意事項 請務必在使用本試劑盒之前閱讀此注意事項。 1.溶液 P1 在使用前先加入 RNase A(將試劑盒中提供的 RNase A 全部加入),混勻,置于 2-8℃保存。 2.使用前請先檢查溶液 P2 和 P3 是否出現渾濁,如有混濁現象,可在 37℃水浴中加熱幾分鐘,即可恢復澄 清。 3.注意不要直接接觸溶液 P2 和 P3,使用后應立即蓋緊蓋子。 4.所有離心步驟均為使用常規臺式離心機室溫下進行離心,速度為 12,000 rpm(~13,400×g )。 5.提取的質粒量與細菌培養濃度、質粒拷貝數等因素有關。 操作步驟 使用前請先在漂洗液PW中加入無水乙醇,加入體積請參照瓶上的標簽。 1.取1-5 ml過夜培養的菌液加入離心管中,12,000 rpm(~13,400×g ) 離心1 min,盡量吸除上清(菌液較多時可以通過多次離心將菌體沉淀收集到一個離心管中)。 2.向留有菌體沉淀的離心管中加入250 μl溶液P1(請先檢查是否已加入RNase A),使用移液器吸吐或渦旋振蕩器徹底懸浮細菌沉淀。 注意:如果有未徹底混勻的菌塊,會影響裂解,導致提取量和純度偏低。 3.向離心管中加入250 μl溶液P2,溫和地上下翻轉6-8次使菌體充分裂解。 注意:溫和地混合,不要劇烈震蕩,以免打斷基因組DNA,造成提取的質粒中混有基因組DNA片斷。此時 菌液應變得清亮粘稠,所用時間不應超過5 min,以免質粒受到破壞。如果未變得清亮,可能由于菌體 過多,裂解不徹底,應減少菌體量。 4.向離心管中加入250 μl溶液P3,立即溫和地上下翻轉6-8次,充分混勻,此時將出現白色絮狀沉淀。12,000 rpm (~13,400×g )離心10 min。 注意:P3加入后應立即混合,避免產生局部沉淀。如果上清中還有微小白色沉淀,可再次離心后取上 清。 5.將上一步收集的上清液用移液器轉移到吸附柱CP1中 (吸附柱放入收集管中),注意盡量不要吸出沉淀。12,000 rpm (~13,400×g)離心30-60 sec,倒掉收集管中的廢液,將吸附柱CP1放入收集管中。 6.向吸附柱CP1中加入700 μl漂洗液PW(請先檢查是否已加入無水乙醇),12,000 rpm(~13,400×g )離心30-60 sec,倒掉收集管中的廢液,將吸附柱CP1放入收集管中。 7.重復操作步驟6。 8.將吸附柱CP1放入收集管中,12,000 rpm (~13,400×g) 離心2 min,目的是將吸附柱中殘余的漂洗液去 除。 注意:漂洗液中乙醇的殘留會影響后續的酶反應(酶切、PCR等)實驗。為確保下游實驗不受殘留乙醇的影響,建議將吸附柱CP1開蓋,置于室溫放置數分鐘,以徹底晾干吸附材料中殘余的乙醇。 9.將吸附柱CP1置于一個干凈的離心管中,向吸附膜的中間部位滴加50-100 μl洗脫緩沖液TB,室溫放置2min,12,000 rpm (~13,400×g) 離心2 min將質粒溶液收集到離心管中。 注意:洗脫緩沖液體積不應少于50μl,體積過小影響回收效率。洗脫液的pH值對于洗脫效率有很大影響,若后續做測序,需使用ddH2O做洗脫液,并保證其pH值在7.0-8.5范圍內,pH值低于7.0會降低洗脫效率。且DNA產物應保存在-20℃,以防DNA降解。為了增加質粒的回收率,可將得到的溶液重新加入吸附柱中,室溫放置2 min,12,000 rpm(~13,400×g) 離心2 min,將質粒溶液收集到離心管中。 低拷貝或大質粒( >10kb)提取 如果所提質粒為低拷貝質粒或大于10 kb的大質粒,應加大菌體使用量,使用5-10 ml過夜培養物,同時按照比例增加P1、P2、P3的用量,洗脫緩沖液TB應在65-70℃水浴預熱,在吸附和洗脫時可以適當的延長時間,以增加提取效率。其它步驟相同

Vipack 病毒包裝轉染試劑
基本售價:360.00元
【操作方法】1. 對于貼壁細胞(以下均以6孔板為例,其它培養皿或培養板請根據相應面積換算):a.將細胞培養于培養皿或培養板內,通常在鋪板后1-2天內長到70-90%。 b. 在轉染前1-2小時,吸去細胞培養液,更換為新鮮的不含抗生素的完全培養液2ml。c. 取2-4μg待轉染的質粒DNA (質粒總體積不宜超過20μl,若有多種質粒請混勻),以質量體積比1:3加入轉染試劑6~12μl(如2μg待轉染的質粒DNA加入轉染試劑6μl)。d.混勻后,室溫孵育3-5分鐘。e. 把DNA-轉染試劑混合物中加入500μl opti-MEM(若無opti-MEM可使用無血清無雙抗的DMEM或1640,具體根據轉染細胞使用的培養基),充分混勻后靜置10-15分鐘。 f.后均勻滴加到整個6孔板內(加入前吸出原培養板中500μl培養基),并置于含5%二氧化碳的37oC細胞培養箱內培養。 g. 在轉染后4-6小時左右換液,更換為2ml新鮮的完全培養液,繼續培養。h.通常在轉染約24-48小時后就可以檢測到轉染基因的表達。2. 對于懸浮細胞: a. 離心收集懸浮細胞,用PBS洗滌一次。 b. 按照上面的步驟c)、d)、e)制備DNA-轉染試劑-optiMEM混合物。c. 每106個細胞的沉淀,用500微升DNA-轉染試劑-optiMEM混合物重新懸浮,室溫放置15-20分鐘。 d. 在一個6孔板孔內加入1.5ml完全培養液,然后加入來自上一步的細胞-500微升DNA-轉染試劑-optiMEM混合物,混勻。e. 在含5%二氧化碳的37oC細胞培養箱內培養。 f. 根據實驗要求和轉染試劑對于不同細胞的毒性不同,在4-6小時后離心收集細胞,用PBS洗一次,然后用2毫升完全培養 液重新懸浮細胞,繼續培養。 g. 通常在轉染約24-48小時后就可以檢測到轉染基因的表達。
NewZOL LS 總RNA提取試劑(NewZOL LS Reagent) 200ml
基本售價:890.00元
功能與使用方法與life品牌的Trizol LS相似 【保存條件】2-8℃長期保存【操作方法】I. 樣本處理1. 組織樣本處理:用勻漿器或其他類似設備勻化組織樣本機械破壞裝置,每 500μL 最多使用 50 mg 組織NewZOL LS。 對于 DNA 含量高的組織(例如脾臟),建議使用 25 mg 組織/ 500μL 試劑。 2. 貼壁細胞樣本處理:除去細胞培養基,通過向培養皿(直徑 3.5 cm,10 cm2)中加入至少 1 mL NewZOLLS 并通過反復吸移來確保完全裂解。(根據培養皿面積而不是細胞數計算試劑量。試劑量不足將導致分離的 RNA 受到 DNA 污染。殘留的勻漿可以在-20 至-80°C 下保存至少一年,以備后用。) 3. 懸浮細胞樣本處理:沉淀細胞,并通過添加 NewZOL LS 直接裂解。 每 5×106個細胞至少加入 500μLNewZOL LS,移液器吹打數次裂解細胞。(添加 NewZOL LS 之前請勿洗滌細胞,細胞洗滌可能會導致 RNA降解。) 4. 液體樣本處理:每 200μL 液體樣品中加入 500μL NewZOL LS 進行均質化和裂解。對于小于 200μL 的樣品體積,請添加 500μLNewZOL LS 并加水至最終體積為 700μL。 5. 富含脂質樣本處理:如上所述均質化富含脂質的樣品。將樣品以 12,000×g 離心 5 分鐘。 離心后,樣品頂部會出現一層脂肪。用移液器吸頭尖端刺穿上層,然后將上清液轉移到新管中。 II. RNA 提取1. 每使用 500μLNewZOL LS 的裂解液中加入 200μL 無 RNase 的水至裂解液中。劇烈搖動樣品 15 秒鐘。在室溫下孵育 5 分鐘。(對于包含 50 mg 組織/ 500μL NewZOL LS 的樣品,建議在室溫下孵育 15 分鐘。) 2. 在室溫下以12,000×g離心樣品15分鐘。含有DNA,蛋白質和多糖的半固體沉淀物形成在試管底部。RNA仍溶解在上清液中。 3. 將 500μL 上清液轉移至新管中。 勿吸太干凈防止污染,在 DNA /蛋白質沉淀上方保留一小部分上清液。(含有 DNA,蛋白質和多糖的沉淀物占勻漿-水混合物總量的約 10%。)4. 加入等體積異丙醇,上下顛倒混勻以沉淀 RNA,在室溫下孵育樣品 10 分鐘。5. 將樣品以 12,000×g 離心 10 分鐘,除去并丟棄上清液。通常,在管的底部以白色沉淀的形式獲得 RNA。對于脾臟樣品,RNA 在試管底部形成凝膠狀膜。用乙醇洗滌后,膜變得更可見。 6. 加入 500μL 75% 乙醇(無 RNase 水配制)洗滌,輕彈管底使沉淀懸浮,上下顛倒混勻。對于較大的試管,按比例添加 75% 乙醇溶液。 7. 將沉淀以 8,000×g 的速度離心 3 分鐘。移液去除沉淀中的乙醇,重復乙醇洗滌步驟一次。靜置 5-10 分鐘待乙醇揮發,無需過份干燥成固體,干燥成固體的 RNA 沉淀不易溶解 8. 將 RNA 沉淀溶于無 RNase 的水中,在室溫下渦旋 3 分鐘,以實現有效溶解。將得到的 RNA 進行檢測或-65℃長期保存(若需更長時間保存請添加適量 RNA Chill(ES-8520))。 【注意事項】1. RNA 酶污染注意事項:a. 提取過程用品均經過去 RNA 酶處理:玻璃制品可以 150 °C 烘烤 4 小時 ,塑料制品可浸泡于 0.5M NaOH 溶液后用清水沖洗并高壓滅菌,吸頭及離心管類盡量使用一次性無酶吸頭及離心管 b. 佩戴手套及口罩及護目鏡:皮膚上常含有細菌和霉菌,可污染 RNA 制備,且同時是 RNA 酶來源,同時 New ZOL LS 對皮膚有一定毒性,建議佩戴手套及口罩及護目鏡。 c. 盡量于通風櫥內提取:避免吸入提取過程中有毒物質。2. 安全性問題:a. 本品在與皮膚接觸及吞咽有毒性,可導致燒傷。與皮膚接觸后,應立即用洗滌劑和大量水沖洗。如感到身體不適,應立即就醫

DNA分子量標準 (250-15000 bp) DNA Ladder (250-15000 bp)
基本售價:80.00元
DNA分子量標準 (250-15000 bp) DNA Ladder (250-15000 bp)產品簡介:本產品為預混有1×上樣緩沖液的即用型DNA分子量標準,由7條線狀雙鏈DNA條帶組成,適用于對250-15000 bp的雙鏈DNA分子大小的估算和粗略定量。條帶組成:250、1000、2500、5000、7500、10000和15000 bp。其中2500 bp條帶濃度較大,為20 ng/μl,其余條帶濃度約為10 ng/μl。儲存液成分:10 mM TrisCl (pH 8.4),10 mM EDTA,0.02%溴酚蘭,5%甘油使用說明:1. 建議用于0.5~1.0%的瓊脂糖凝膠電泳,不推薦用于聚丙烯酰胺凝膠電泳;2. 電泳緩沖液可選用1x TAE 或0.5~1x TBE,電壓6~8 v/cm 膠長,電泳時間30~60分鐘;3. 根據上樣孔寬度,用滅菌槍頭吸取5ul本產品,加入上樣孔中;4. 加入待檢測DNA 樣品后開始電泳;5. 電泳結束后,使用溴化乙啶(EB)或其它DNA 染料染色并觀察電泳條帶。注意事項:1. 經檢測,本品室溫放置三個月帶型無變化;但建議低溫保存,以防因操作不慎導致核酸酶污染而引起條帶降解;2. 使用前請勿加熱;3. 當電泳緩沖液緩沖能力下降時應及時更換電泳緩沖液,以免影響分辨效果。
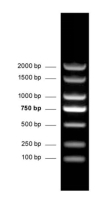
DNA分子量標準 (100-2000 bp) DNA Marker (100-2000 bp)
基本售價:71.00元
DNA分子量標準 (100-2000 bp) DNA Marker (100-2000 bp)產品簡介: 本產品為預混有1×上樣緩沖液的即用型的穩定、清晰、精準的DNA 分子量標準,由 7 條線狀雙鏈 DNA 條帶組成,適用于對 100~2000 bp 的雙鏈 DNA 分子大小的估算和粗略定量。條帶組成:100、250、500、750、1000、1500、2000bp。其中 750 bp 條帶濃度 最大,為 100 ng/5 μl,其余條帶濃度約為 50 ng/5 μl 。使用說明:1. 建議用于0.5~1.0%的瓊脂糖凝膠電泳,不推薦用于聚丙烯酰胺凝膠電泳;2. 電泳緩沖液可選用1x TAE 或0.5~1x TBE,電壓6~8 v/cm 膠長,電泳時間30~60分鐘;3. 根據上樣孔寬度,用滅菌槍頭吸取5~10ul本產品,加入上樣孔中;4. 加入待檢測DNA 樣品后開始電泳;5. 電泳結束后,使用溴化乙啶(EB)或其它DNA 染料染色并觀察電泳條帶。注意事項:1. 經檢測,本品室溫放置三個月帶型無變化;但建議低溫保存,以防因操作不慎導致核酸酶污染而引起條帶降解;2. 使用前請勿加熱;3. 當電泳緩沖液緩沖能力下降時應及時更換電泳緩沖液,以免影響分辨效果。 PCR Marker
 中文
中文