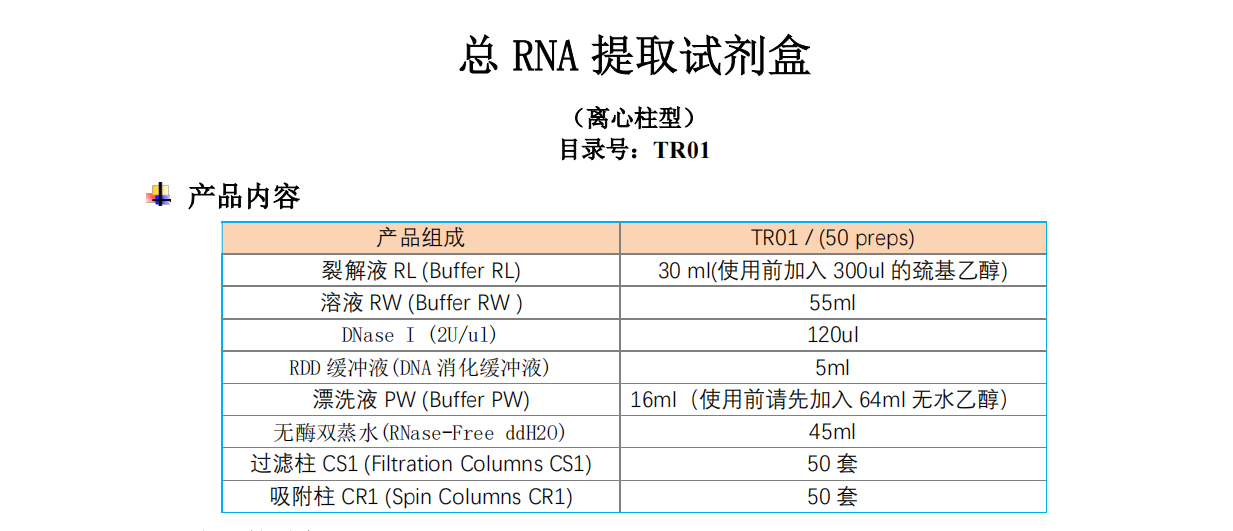
選配的試劑
蛋白酶K(20mg/ml)目錄號:GF0202-01,客戶自備,提取動(dòng)物組織總RNA時(shí)需配備 溶菌酶(50mg/ml)目錄號:GF0203-01,客戶自備,提取細(xì)菌總RNA 時(shí)需配備
 儲(chǔ)存條件
儲(chǔ)存條件
DNase I溶液(DNase I 凍干粉溶解于專用保存液),儲(chǔ)存于-20℃,可反復(fù)凍融; 其他試劑室溫(15-25℃)保存。
 產(chǎn)品簡介
產(chǎn)品簡介
總RNA提取試劑盒提供了快速簡單且有效的方法,可從各種動(dòng)物組織、培養(yǎng)細(xì)胞及細(xì)菌、植物組織、 中提取總RNA。本試劑盒采用離心管柱的方式,配合使用我司獨(dú)特的硫氰酸胍裂解液,使組織或細(xì)胞裂解 及均質(zhì)化,并加入乙醇使RNA選擇性的與管柱膜結(jié)合,于操作過程中加入DNase Ⅰ以去除殘留的基因組DNA,經(jīng)過多次“洗滌及離心”的步驟去除污染雜質(zhì),再以無核酸酶水回收結(jié)合在管柱膜上的RNA。若RNA 小于200nt,如5sRNA、tRNA和microRNA,無法在此系統(tǒng)中被有效地回收。提取的總RNA純度高,基本沒有DNA 和蛋白質(zhì)污染,可用于PCR、芯片分析、Blot、PolyA 篩選、體外翻譯、RNase 保護(hù)分析和分子克隆等多種下游實(shí)驗(yàn)。
本試劑盒同樣適用酵母,可以從酵母菌中提取總RNA,具體操作方法見“附錄Ⅰ”。
本試劑盒也可用于將以其他方法提取的 RAN 進(jìn)行clean up 或去除基因組DNA 污染,詳見“附錄Ⅱ”。
 預(yù)防RNase污染,應(yīng)注意以下幾方面
預(yù)防RNase污染,應(yīng)注意以下幾方面
1. 經(jīng)常更換新手套,因?yàn)槠つw經(jīng)常帶有細(xì)菌,可能導(dǎo)致RNase污染。
2. 使用無RNase的塑料制品和槍頭避免交叉污染。
3. RNA在裂解液RL中時(shí)不會(huì)被RNase降解。但提取后繼續(xù)處理過程中應(yīng)使用不含RNase的塑料和玻璃器皿。玻璃器皿可在150℃烘烤4 h,塑料器皿可在0.5 M NaOH中浸泡10 min,然后用水徹底清洗,再滅菌,即可去除RNase。
4. 配制溶液應(yīng)使用無RNase的水(將水加入到干凈的玻璃瓶中,加入DEPC至終濃度0.1%(V/V),高壓滅菌)。
![]() 使用前注意事項(xiàng)
使用前注意事項(xiàng)
1. 使用前請向裂解液RL 添加 350ul 巰基乙醇,添加過巰基乙醇的裂解液 4℃保存。
2. 使用前請向漂洗液PW 添加 64ml 無水乙醇。
3. 為確保RNA 的品質(zhì)及產(chǎn)量,應(yīng)盡量收取新鮮的動(dòng)物組織進(jìn)行 RNA 提取,或?qū)⒔M織立即以液氮冷凍,儲(chǔ)存于-70℃,組織亦可保存在RANstore 樣本保存液(目錄號:TR38)中。樣本保存在 RNAstore 試劑中,可于37℃存放 1 天、4℃存放 1 個(gè)月、-20℃永久保存,所提取的 RNA 品質(zhì)與儲(chǔ)存在液氮中相同。
 操作步驟
操作步驟
一、從培養(yǎng)細(xì)胞中提取總 RNA
1. 收集細(xì)胞
a. 懸浮細(xì)胞的收集(收集細(xì)胞數(shù)量請不要超過 1×107):估計(jì)細(xì)胞數(shù)量,300×g 離心 5 min,將細(xì)胞收集到離心管中,仔細(xì)吸除所有培養(yǎng)基上清。
b. 單層貼壁細(xì)胞的收集(收集細(xì)胞數(shù)量請不要超過 1×107):可直接在培養(yǎng)容器中裂解(容器直徑不超過 10 cm),或者使用胰蛋白酶處理后離心收集細(xì)胞沉淀。(在搖瓶中培養(yǎng)的單層貼壁細(xì)胞通常采用胰蛋白酶處理的方法。)
? 直接裂解法:確定細(xì)胞數(shù)量,徹底吸除細(xì)胞培養(yǎng)基上清,立即進(jìn)行第 2 步裂解步驟。
? 胰蛋白酶處理法:確定細(xì)胞數(shù)量,吸除培養(yǎng)基,用 PBS 洗滌細(xì)胞,吸除 PBS,向細(xì)胞中加入含有0.10-0.25%胰蛋白酶的 PBS 處理細(xì)胞,當(dāng)細(xì)胞脫離容器壁時(shí),加入含有血清的培養(yǎng)基失活胰蛋白酶,將細(xì)胞溶液轉(zhuǎn)移至RNase-Free 的離心管中,300×g 離心 5 min,收集細(xì)胞沉淀,仔細(xì)吸除所有上清。
注意:收集細(xì)胞時(shí)一定要將細(xì)胞培養(yǎng)液去除干凈,否則會(huì)導(dǎo)致裂解不完全,影響 RNA 與吸附柱的結(jié)合, 造成RNA 的產(chǎn)量降低;請勿使用過多的樣本量,避免管柱杜塞而造成 RNA 的產(chǎn)量降低。
3. 將所有溶液轉(zhuǎn)移至過濾柱 CS1 上(過濾柱 CS1 放在收集管中),12,000 rpm(~13,400×g)離心 2min,收集濾液。
4. 向?yàn)V液加入等體積 70%乙醇至裂解液中,混勻(此時(shí)可能會(huì)出現(xiàn)沉淀),轉(zhuǎn)至后面“RNA 提取步驟”。
二、從動(dòng)物組織中提取總 RNA
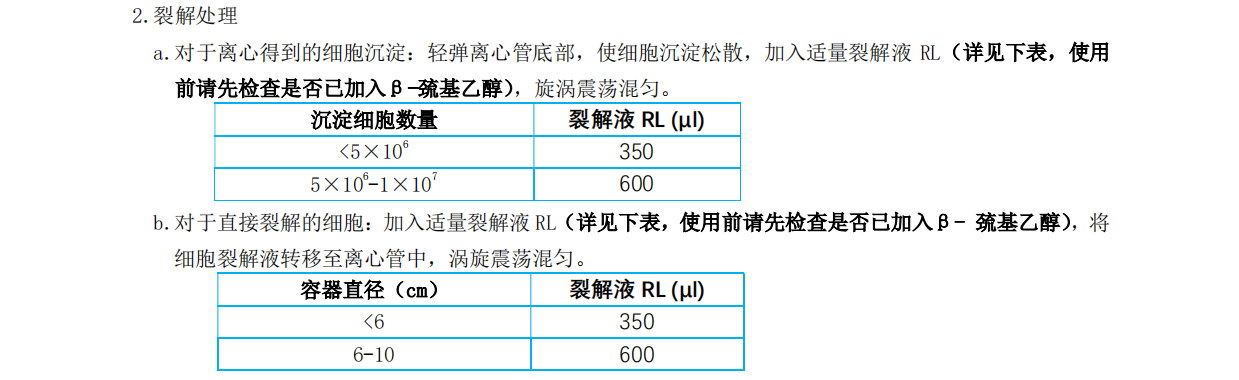
1. 勻漿處理:
每 10-20 mg 組織加 300 μl 裂解液RL(使用前請先檢查是否已加入 β-巰基乙醇),用研磨杵將組織徹底研磨(如組織較難徹底研磨,可選用電動(dòng)或玻璃勻漿器);隨后向勻漿液 中加入 590 μl RNase-Free ddH2O 和
10 μl Proteinase K(20mg/ml),混勻后 56℃處理 10-20 min。
注意:組織量一定不要超過 20 mg,否則將導(dǎo)致RNA 得率和質(zhì)量下降。
2. 將裂解混合液轉(zhuǎn)移至過濾柱 CS1(過濾柱 CS1 放入收集管中),12,000 rpm(~13,400×g)離心 2min,收集濾液。
3. 向?yàn)V液加入 0.5 倍上清體積的無水乙醇,均勻(此時(shí)可能會(huì)出現(xiàn)沉淀),轉(zhuǎn)至后面“RNA 提取步驟”。
三、從細(xì)菌中提取總RNA
1.4℃12,000 rpm(~13,400×g)離心 2 min 收集菌體(收集菌體的最大量不超過 1×109),仔細(xì)去除所有培養(yǎng)基上清,以后的所有離心步驟均在室溫(20-25℃)進(jìn)行。
注意:如果培養(yǎng)基上清去除不完全,將對第二步中的細(xì)胞壁消化過程產(chǎn)生抑制。
2. 用含有溶菌酶的 100μl TE 緩沖液(客戶自己配制,配制方法見下表)徹底重懸菌體,孵育時(shí)間見下表。
|
|
TE 緩沖液中的溶菌酶終濃度 |
孵育時(shí)間(室溫) |
|
G-細(xì)菌 |
400 μg/ ml |
3-5 min |
|
G+細(xì)菌 |
3 mg/ ml |
5-10 min |
3. 加入 350μl 裂解液 RL(使用前請先檢查是否已加入β-巰基乙醇),渦旋振蕩混勻。
4. 將裂解混合液轉(zhuǎn)移至過濾柱 CS1 上(過濾柱CS1 放入收集管),12,000 rpm(~13,400×g)離心 2min,收集濾液。
5. 向?yàn)V液中加入 250μl 無水乙醇,混勻(此時(shí)可能會(huì)出現(xiàn)沉淀),轉(zhuǎn)至后面“RNA 提取步驟”。
四、從植物組織中提取總 RNA
本試劑盒不適用于富含淀粉、酚類和次級代謝物的植物組織(例如一些木本植物,胚乳或絲狀真菌的菌 絲體),因?yàn)?2-ME/裂解液在加入至樣本粉末后,會(huì)變固態(tài)或非常粘稠,此類植物組織請使用“多糖多酚植物總RNA 提取kit”(貨號 TR22)。
1. 勻漿處理
50-100 mg 植物葉片在液氮中迅速研磨成粉末,加入 450 μl RL(使用前請先檢查是否已加入β-巰基乙醇),渦旋劇烈震蕩混勻,并于 56℃孵育 3 分鐘。
注意 1:在 56℃孵育 1-3 min 將有助于植物組織裂解,但是對于某些富含淀粉的樣品,請不要加熱處理, 防止因淀粉引起的樣品膨脹現(xiàn)象。
注意 2:由于植物多樣性非常豐富,而且同種植物的不同生長發(fā)育階段和不同組織的 RNA 含量都不相同, 請根據(jù)具體實(shí)驗(yàn)情況選擇合適的植物材料的用量。
2. 將所有溶液轉(zhuǎn)移至過濾柱 CS1 上(過濾柱 CS1 放在收集管中),12,000 rpm(~13,400×g)離心 2-5 min,小心吸取收集管中的上清至RNase-Free 的離心管中,吸頭盡量避免接觸收集管中的細(xì)胞碎片沉淀。
注意:由于裂解液較粘稠,所以將溶液轉(zhuǎn)移至過濾柱時(shí),可以剪去部分吸頭末端。
3. 緩慢加入 0.5 倍上清體積的無水乙醇,混勻(此時(shí)可能會(huì)出現(xiàn)沉淀),轉(zhuǎn)至“RNA 提取步驟”。
u RNA 提取步驟
此為續(xù)接樣本制備“一、二、三、四、五”后的RNA 提取操作步驟。
1. 將前一步所得“裂解液/乙醇混合液”(含沉淀),移取至吸附柱 CR1 中(吸附柱 CR1 放入收集管中),12,000 rpm (~13,400×g )離心 30-60 sec,倒掉收集管中的廢液,將吸附柱 CR1 放回收集管中。
注意:將溶液和沉淀轉(zhuǎn)移至吸附柱CR1 時(shí),如果體積大于吸附柱容量,可以分次完成。
2. 向吸附柱CR1 中加入 500ul 溶液RW,12,000 rpm (~13,400×g )離心離心 1 min,丟棄濾液,將吸附柱CR1 放回收集管中。
3. DNase Ⅰ降解。
每一純化反應(yīng),請將 80 ul DNase 消化液與 2ul DNaseⅠ預(yù)先混合在新的離心管(輕彈或翻轉(zhuǎn)離心管以混合均勻,請勿震蕩),將 82 ul “DNaseⅠ工作液”加入至吸附柱的膜中心,于室溫(25~28℃)孵育15 分鐘。
注意:如同時(shí)操作多組樣本,請使用前現(xiàn)配新鮮的 DNaseⅠ工作液,請勿預(yù)先配制保存 DNaseⅠ工作液。4.向吸附柱CR1 中加入 500μl 溶液RW,12,000 rpm(~13,400×g)離心 1 min,倒掉收集管中的廢液,將吸
附柱CR1 放回收集管中。
5. 向吸附柱CR1 中加入 600μl 漂洗液 PW(使用前請先檢查是否已加入乙醇),12,000 rpm(~13,400×g) 離心 1 min,倒掉收集管中的廢液,將吸附柱CR1 放回收集管中。
6. 重復(fù)操作步驟 5。
7.12,000 rpm(~13,400×g)離心 3 min,將吸附柱CR1 置于室溫放置數(shù)分鐘,以徹底晾干吸附材料中殘余的乙醇。
注意:此步驟目的是將吸附柱中殘余的漂洗液去除,離心后將吸附柱 CR1 在室溫放置片刻,以充分晾干。如果有漂洗液殘留,可能會(huì)影響后續(xù)的 RT 等實(shí)驗(yàn)。
8. 將吸附柱CR1 轉(zhuǎn)入一個(gè)新的 RNase-Free 離心管中,加入 30-100 μl 無酶雙蒸水至吸附柱的膜中心,室溫靜置 2 min,12,000 rpm(~13,400×g)離心 1 min,得到 RNA 溶液。
注意:洗脫緩沖液體積不應(yīng)少于 30 μl,體積過小影響回收效率;RNA 溶液請于-70℃保存。
 附錄Ⅰ:從酵母菌中提取總 RNA
附錄Ⅰ:從酵母菌中提取總 RNA
一、需要自備的試劑:
a.溶壁酶(Lyticase):目錄號 GF0210-01 b.山梨醇 buffer:
用0.1M磷酸鈉緩沖液(pH7.4)配制1.2 M山梨醇;
0.1M磷酸鈉緩沖液(pH7.4)的配制:77.4 ml 0.1 mol/L Na2HPO4+ 22.6ml 0.1mol/L NaH2PO4
二、操作步驟
1. 取酵母細(xì)胞(最多不超過5×107cells),12,000 rpm(~13,400×g )離心1 min,盡量吸除上清(菌液較多時(shí)可以通過幾次離心將菌體沉淀收集到一個(gè)離心管中)。
2. 酵母細(xì)胞壁的破除:
酶法:向菌體中加入1ml山梨醇buffer,加入大約50U Lyticase(需自備,我司目錄號:GF0210-01)充分混勻,30℃孵育30min,300×g離心5 min,棄上清,收集沉淀。
注意:以上為5×107酵母細(xì)胞的Lyticase用量,根據(jù)酵母的菌株和酵母細(xì)胞數(shù)量的不同,所用Lyticase 的濃度和孵育時(shí)間應(yīng)該進(jìn)行適當(dāng)調(diào)整。
3. 加入 350 μl 裂解液 RL(在使用前請加入 β-巰基乙醇),渦旋振蕩混勻,將裂解混合液轉(zhuǎn)移至過濾柱 CS1
上(過濾柱 CS1 放入收集管中),12,000 rpm(~13,400×g)離心 2min,收集濾液。
4. 向?yàn)V液中加入 350μl 70%乙醇,混勻(此時(shí)可能會(huì)出現(xiàn)沉淀),轉(zhuǎn)至上面“RNA 提取步驟”。
 附錄Ⅱ:RNA Clean -Up 或基因組 DNA 去除。
附錄Ⅱ:RNA Clean -Up 或基因組 DNA 去除。
本試劑盒可用于將以其他方法提取的 RAN 進(jìn)行clean up 或去除基因組DNA 污染。
1. 將RNA 以無酶水調(diào)整體積至 100ul,加入 350ul 的裂解液 RL(使用前請加入β 巰基乙醇),混合均勻。
2. 加入 250ul 的無水乙醇至裂解液中,混勻,轉(zhuǎn)至上面“RNA 提取步驟”。
作者:Jianhong Zhou ,Lingzhou Zhao 影響因子:4.259
期刊:《Scientific Reports 6, Article number: 29069 (2016)》 PMID:27353337
| 用戶名: | (可為空) |
| E-mail: | *(必填) |
| 評價(jià)等級: |





|
| 評論內(nèi)容: |
*(必填)
|
 中文
中文 


